Hexogen
http://judr.pierun.sweb.cz/bum/hexog.htm
Hexogen
Vlastnosti RDX: Hexogen, alicyklický nitramin chemicky lze pojmenovat několika názvy podle toho, jak na něj pohlížíme. Jsou to např. 1,3,5-cyklotrimethylentrinitramin nebo 1,3,5-trinitro-1,3,5-triazocyklohexan. Ve vojenství se nejčastěji používá mezinárodních názvů Hexogen a Cyklonit(odvozeno od cyklické struktury a zároveň od Cyklonu-tropické bouře). Jako zkratka se uvádí RDX, ve specifické munici pak T4. 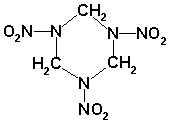
RDX tvoří bílý jemně krystalický prášek teploty tání 203°C , nerozpustný ve vodě a organických rozpouštědlech.
Rozpustnost ve vodě při 0°C je 0,01% a při 100 °C 0,15%. Z organických rozpouštědel je dobře rozpustný v acetonu (6,81% při 20°C a 15,3% při 58°C), v ostatních rozpouštědlech pod 1%.
Stykem s kyselinou sírovou o koncentraci nad 70% se zcela rozkládá na formaldehyd a další produkty. Díky této vlastnosti nelze bohužel použít k preparaci nitrační směs obsahující H2SO4.
Hexogen je stabilní, nereaguje s kovy, nevytváří soli, pH neutrální.
Hexogen je vysoce brizantní trhavinou patřící mezi nejsilnější výbušniny. Používá se v náplních rozbušek, počinových náložkách, ve směsích s velkým množstvím jiných výbušnin, nejvíce s TNT(Hexolity), hliníkem(Hexaly), dusičnanem amonným(Ammatexy), v plastických trhavinách(Semtexy, kompozice C-4, Hexoplasty).
Stabilita
Velkou předností je jeho velká chemická stabilita , blížící se aromatickým nitrolátkám. Často bývá srovnáván s Pentritem, ale narozdíl od něj je stabilnější, má nižší citlivost a při vysokých hustotách i vyšší brizanci.
Při zahřívání a vystavení dlouhodobému tepelnému účinku je stabilnější než pentrit a při teplotě nad bodem tání Tetrylu(140°C )má větší stabilitu než Tetryl.
Z uvedeného vyplývá, že stabilita hexogenu je vyšší než Tetrylu a podle některých odborných prací je dokonce obdobná TNT.
Účinek světla má jen nepatrný vliv na změnu vlastností. Působením světla obsahujícího ÚV spektrum dochází pouze na povrchu ke změně barvy z bílé na jasně žlutou. Změna barvy souvisí se změnou krystalové struktury, ale chemické a výbušinářské vlastnosti zůstávají beze změny.
S ohledem na ostatní výbušniny je hexogen poměrně málo jedovatý, nepůsobí přes pokožku, ale přímou inhalací. Příčinou malé jedovatosti je špatná rozpustnost, která způsobuje, že se nedostává do krve ve vysoké koncentraci. Při dlouhodobém vdechování se objevují toxicko-klinické křeče, které nastávají v 10 minutových intervalech a po odstranění osoby ze zamořeného prostoru nemizí. Příznaky otravy odeznívají teprve po 10-24 hodinách.
Výbušinářské vlastnosti
| Vlastnost | Hodnota |
|---|---|
| Energie explose (E): | 1390 kcal.kg-1 |
| Objem výbušných plynů (Vo): | 910 dm3 .kg-1 |
| Teplota výbuchu (t): | 3380°C |
| Teoretická síla (Force): | 12 600 |
| Trauzlův válec: | 470 cm3 |
| Poměrná síla k TNT: | 180 % |
| Citlivost na padacím kladivu(2kg): | 32 cm (Tetryl =40 a Pentrit = 28 cm) |
| Detonační rychlost (D max.): | 8800 m.s-1 (při 1,82 g.cm-3) |
| Maximální detonační tlak: | 349 960 bar |
| 50 % detonací vyvolá práce 0,22 kgm/cm2 |
Teorie výroby RDX nitrolýzou hexaminu
Od objevení hexogenu bylo popsáno přibližně 30 různých metod na jeho syntézu. Z tohoto počtu je 14 metod laboratorně proveditelných.
My si ukážeme tu nejstarší a nejjednodušší -nitrolýzu bezvodou kyselinou dusičnou. V dalších dílech pak přidáme i jiné výrobní postupy..
Podle této metody se k ochlazené bezvodé kyselině dusičné přisypává po malých dávkách urotropin, teplota se udržuje na 30°C . Koncentrace HNO3 je minimálně 98% .
Reakce probíhají podle rovnic:
(CH2)6N4 + 6 HNO3 ——–> (CH2.N.NO2)3 + 6 H2O + 3 CO2 + 2 N2
(CH2)6N4 + 4 HNO3 ——–> (CH2.N.NO2)3 + 3 CH2O + NH4NO3 .
Průběh vyjadřují obě rovnice bez ohledu na množství použité HNO3, neboť při reakci vznikají všechny uvedené produkty. Část methylenových skupin a dusíkových atomů hexamethylentetraminu není využito a rozpadají se. Prakticky se k nitraci hexaminu používá 8 násobného přebytku kyseliny dusičné oproti teorii. Použitím menšího množství dojde k nevýhodnému ustálení rovnováhy zředěním kyseliny vznikající vodou a výtěžky jsou mizivé.
Vedle hlavních nitračních reakcí probíhají ještě vedlejší reakce hydrolýzy hexaminu na formaldehyd, a oxydace vzniklého formaldehydu:
(CH2)6N4 + 6 H2O ——-> 4 NH3 + 6 CH2O
2 CH2O + 2 HNO3 ——-> 2 HCOOH + H2O + NO + NO2 .
Uvedená reakce oxydace formaldehydu též přispívá ke zvýšené spotřebě HNO3 .
Mimo uvedené vedlejší reakce mohou probíhat i další, jejichž produktem jsou složité lineární a cyklické struktury. Vznik vedlejších látek tohoto typu se vysvětluje na principu postupné nitrolýzy aminu, při které dochází k roztržení vazeb mezi atomy dusíku a uhlíku.
V první fázi nitrolýzy hexaminu vzniká sloučenina (označme ji jako 1):
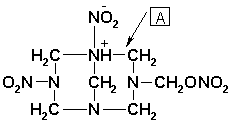
V další fázi dochází k esterifikaci vzniklé alkoholické skupiny a v důsledku nitrolýzy k roztržení vazby dusík-uhlík v místě A za vzniku následující sloučeniny:
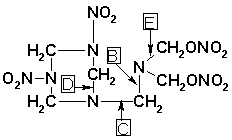
Uvedená sloučenina může další nitrolýzou rozštěpovat vazby v naznačených místech(B, C, D, E).
Rozštěpením vazby v místě B vzniká produkt :
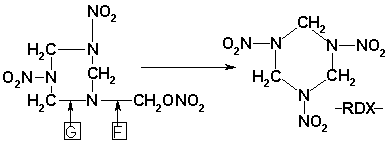 ,
který nitrolyzou v místě F dává hexogen .
,
který nitrolyzou v místě F dává hexogen .
Dojde-li k rozštěpení vazby v místě G, vzniká uvedená nestabilní lineární sloučenina:
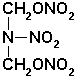
Rozštěpením vazby v místě D a E vzniká lineární nitramin:
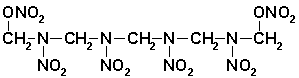 ,
který je velmi citlivý k nárazu a nestabilní. Jeho přítomnost v hexogenu je proto také nežádoucí.
,
který je velmi citlivý k nárazu a nestabilní. Jeho přítomnost v hexogenu je proto také nežádoucí.
Vrátíme-li se na začátek, pak v první fázi vznikající sloučenina 1 může nitrolýzou poskytnout cyklickou látku s osmičlenným kruhem:
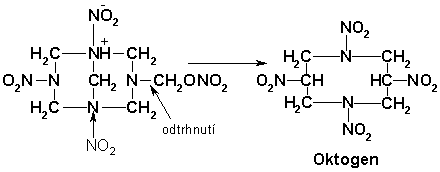
Jde o Oktogen, který vždy provází hexogen a snižuje teplotu tání výsledného produktu. Přítomnost oktogenu je do jisté míry žádoucí, protože zvyšuje jeho brizanci a neovlivňuje stabilitu.
Dalším vedlejším produktem nitrolýzy hexaminu může vznikat trimethylolamintrinitrát:
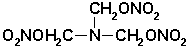
Tento ester je nestabilní a snadno se exotermicky rozkládá.
Při probíhání vedlejších oxidačních reakcí může vznikající formaldehyd reagovat s bezvodou kyselinou dusičnou a místo převažujícího oxidačního procesu může vzniknout nestabilní methylenglykoldinitrát:
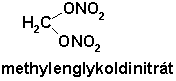
Téměř všechny vznikající vedlejší produkty jsou vesměs nestabilní a při vysrážení hexogenu zůstávají v odpadní kyselině. V odpadní kyselině probíhají vzájemné oxidačně-exotermní reakce, jejichž průběh může vést k výbuchu.
Kyselina z nitrace se proto nesmí skladovat.
Část těchto produktů je v odpadní kyselině špatně rozpustná, znečišťuje a snižuje stabilitu hexogenu.
Pro přečištění surového hexogenu lze použít 2 metod.
V první z nich se celá reakční směs nalévá do horké vody tak, aby se udržela teplota 80-90°C . Dochází ke vzniku velkého množství oxidu dusičitého a přítomné nestabilní produkty se rozloží, vysrážený hexogen se odfiltruje.
Druhá metoda spočívá v rekrystalizaci surového hexogenu z acetonu.
Vedlejší reakce způsobují, že výtěžky hexogenu dosahují maximálně 75-80% teorie. Ze 100g hexaminu tak lze získat 110-119g RDX.
Reakční kinetika a vliv koncentrace HNO3 na výtěžek : Reakční rychlost a výtěžek nitrace hexaminu kyselinou dusičnou o rozdílné koncentraci při teplotě 0°C udává následující diagram:
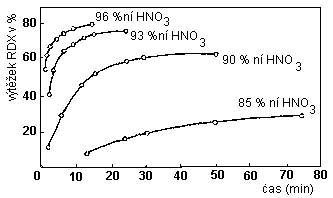
Komentář
Z grafu vyplývá, že se snižující se koncentrací kyseliny roste i čas potřebný k úplnému proběhnutí reakce. Zároveň se i snižuje výtěžek hexogenu.
Při koncentraci HNO3 85 % lze dosáhnout výtěžek max. 28%, zatímco při použití 96% HNO3 je výtěžek až 80 % a reakce je skončena po 15 minutách.
Krajně akceptovatelnou koncentrací HNO3 pro nitrolýzu hexaminu je 93 % s výtěžkem hexogenu 70-72 %, ale k dosažení takového výtěžku je zapotřebí většího přebytku kyseliny(místo používaného poměru 1:8 se musí použít alespoň 1:12 (hexamin : HNO3) ).
V praxi se nepoužívá nižší koncentrace než 98 % HNO3 a poměru hexamin/HNO3 =1:8 .
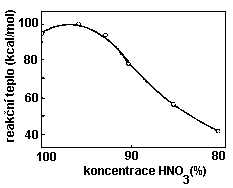 Závislost reakčního tepla nitrace hexaminu na koncentraci kyseliny dusičné je uvedena v následujícím grafu:
Závislost reakčního tepla nitrace hexaminu na koncentraci kyseliny dusičné je uvedena v následujícím grafu:
Při nižší koncentraci kyseliny se uvolňuje i menší teplo. To je asi tak jediná výhoda použití zředěné HNO3 , nevýhodou je velmi malý výtěžek(do 20%) a nutnost použít více než 35 násobný přebytek kyseliny.
Mezní koncentrace kyseliny dusičné, kterou lze ještě připravit hexogen je 80%.
Při nižší koncentraci zcela převládnou oxidační procesy a hexamin”vyhoří” .
Při dávkování hexaminu do kyseliny dusičné se uvolňuje poměrně velké reakční teplo a směs se musí intenzivně ochlazovat chladícím roztokem solanky na teplotu 20°C . Při této teplotě trvá průmyslová nitrace 1 hodinu.
Konec teorie, vrhněme se na praxi.
Laboratorní postup výroby RDX nitrolýzou hexaminu
Chemikálie a pomůcky
- kyselina dusičná 96-99% (konc. H2SO4 a konc. HNO3 k destilaci)
- hexamethylentetramin čistý
- močovina
- chladící lázeň (led + NaCl v poměru 3:1)
- teploměr s rozsahem 0- 40°C
- baňka s širším hrdlem o objemu 250 ml
Destilace vysokoprocentní kyseliny dusičné
K úspěšné nitraci je zapotřebí téměř bezvodé kyseliny dusičné, která se běžně nedá koupit a musíme ji vydestilovat z nitrační směsi H2SO4 + HNO3 nebo rozkladem dusičnanu kyselinou sírovou a předestilováním bezvodé kyseliny dusičné.
V obou případech budeme potřebovat zábrusovou destilační aparaturu.
Do destilační baňky o objemu 800-1000ml nalijeme 200 ml 65%ní kyseliny dusičné a za míchání krouživými pohyby baňkou přidáváme 350 ml 94-98%ní kyseliny sírové . Směs se bude při smíchávání silně zahřívat. Baňku s kyselinami umístíme do olejové lázně a nasadíme sestupný chladič. Olejovou lázeň zahřejeme na 110-125°C a při této teplotě destilujeme bezvodou kyselinu dusičnou, dokud odtéká kondenzát. Nesmíme zapomenout vhodit varný kamínek, jinak se může baňka utajeným varem roztrhnout.
Získáme cca 108-110 ml kyseliny dusičné o hustotě 1,500-1,513 g.cm-3 (což odpovídá koncentraci 94,0-99,1 % HNO3), tj. 90% teorie.
Při destilaci dochází vlivem vysoké teploty ke vzniku oxidu dusičitého, který zbarvuje vzniklou HNO3 do žluté barvy. Obsah rozpuštěného oxidu dusičitého nesmí být vyšší než 4% jinak může při nitraci dojít k silné exotermické reakci a hexamin buďto vyhoří nebo v horším případě může směs vybuchnout. Při destilaci je vhodné obalit chladič alobalem, to zabrání přístupu světla, které podporuje rozklad kyseliny na oxidy dusíku a také to usnadní chlazení.
Stejným postupem, ale za použití vakua získáme kyselinu dusičnou o vysoké koncentraci bez obsahu rozpuštěného NO2 resp. N2O4.
Nitrolýza hexaminu
Do baňky o objemu 250ml nalijeme 100ml získané HNO3 a vložíme do chladící lázně z NaCl a ledu. Když teplota klesne pod 0°C, přidáme 2g práškové močoviny. V případě vysokého obsahu oxidu dusičitého (a jeho dimeru) nastane mírný vývoj oxidu uhličitého a dusíku. Původně žlutá kyselina se nyní částečně odbarví. Takto se jednak zbavíme části přebytečného oxidu dusičitého a následně bude přídavek močoviny snižovat oxidační procesy v počátku reakce. 2. K ochlazené a oxidů zbavené kyselině dusičné pomalu přidáváme hexamin po 2 g dávkách takovou rychlostí, aby se směs nezahřála nad teplotu 25°C . Optimální je po každé dávce schladit směs na 0-5°C a teprve poté přidat další hexamin.
Při dávkování musíme baňkou intenzívně míchat, jinak dojde k místnímu přehřátí.
Pauzy potřebné na ochlazení kyseliny mezi dávkováním hexaminu jsou značně individuální a závisí na intenzitě chlazení a trochu i na chemikově zručnosti.
Při správném postupu trvá ochlazení na požadovanou teplotu 0-5°C asi 2-4 minuty.
Tímto způsobem přidáme do kyseliny celkem 20g hexaminu, který přidáme během 20-40 minut . 3. Po přidání veškerého hexaminu necháme teplotu kontrolovaně stoupnout na 20-25°C a tuto teplotu udržujeme 1 hodinu. Baňkou neustále mícháme. 4. Po hodině nitrace (správněji nitrolýzy) vylijeme celý obsah do kádinky s 500ml studené vody. Vysráží se hexogen jako bílý nerozpustný prášek, který dekantujeme a několikrát promyjeme vodou. Nakonec jej zfiltrujeme a vysušíme.
Čištění hexogenu rekrystalizací
Získaný hexogen obsahuje 0,5% kyselosti, která běžným promýváním nelze odstranit a musíme použít rekrystalizaci z acetonu.
Ke 100 ml acetonu zahřátého na 40-45°C přisypeme 10g hexogenu a lehce promícháme až se rozpustí. Ještě horký roztok vlijeme do 200ml 5% roztoku uhličitanu sodného(Na2CO3) a nakonec přilijeme ještě 400ml studené vody.
Tímto způsobem se vysráží velmi jemný mikrokrystalický hexogen.
Pokud bychom chtěli získat hexogen ve formě dlouhých krystalků (proč?), můžeme k horkému roztoku acetonu přidat pár kapek vody a nechat směs volně krystalizovat.
Výtěžek
Z uvedeného množství chemikálií získáme 20g čistého hexogenu, což odpovídá výtěžku 72% teorie (počítáno na methylové skupiny v hexaminu).